Constat : le séquençage, un générateur fantastique de données
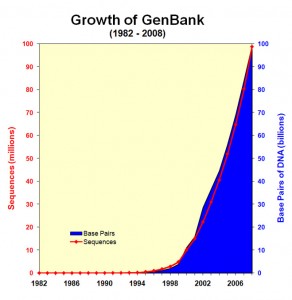
L’explosion de la génération de données génomiques (Figure 1.0) et l’hétérogénéité de ces données entraînent inévitablement un accroissement de l’écart entre les données, les connaissances et l’information que l’on peut en extraire (Figure 1.1).
Le développement d’outils bioinformatiques permet de répondre à l’analyse de données dans l’ensemble des domaines de la biologie, mais le besoin en formalisation (des formats, des processus, des architectures matérielles…) est primordial si l’on veut éviter les problèmes d’incompatibilité et de réutilisation des solutions.
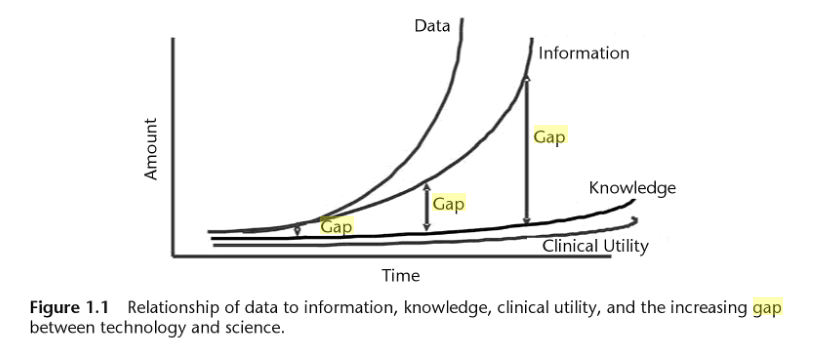
Figure 1.1 : Issu de "Biomedical informatics in translational research" Par Hai Hu,Richard J. Mural,Michael N. Liebman
En conséquence, afin d’obtenir des informations interprétables biologiquement à partir de ces données, la mise en place de processus d’analyse va de pair avec l’utilisation de logiciels à jour, efficaces pour la gestion de données à grande échelle.
En outre, les logiciels doivent aussi simplifier cette gestion de données et fournir des outils d’analyses bioinformatiques accessibles mais aussi reproductibles pour tous types d’utilisateurs – dont les biologistes eux-mêmes. C’est dans ce cadre que s’insèrent l’automatisation de processus (ou « Workflow ») et le développement de « Workflow management system », ou logiciel de Workflow, pour la bioinformatique.
Workflow ou automatisation de processus : définition
Le logiciel de Workflow s’inscrit aussi dans une logique de pérennisation des processus analytiques, qui a pour but de sortir de la logique « projet » (dans le sens ponctuel) en créant des processus d’analyses génériques.
Un logiciel de Workflow est un outil permettant d’exécuter un ensemble de processus de façon automatique. Ces « pipelines » sont très présents en bioinformatique (à défaut d’être tres utilisés) car ils permettent aux chercheurs en biologie d’analyser leurs données (issues de séquencages, génotypages) de façon relativement transparente et (quasiment) sans l’aide d’informaticiens (denrées rares dans la recherche).
Toutefois, il convient de distinguer deux sortes de logiciel de Workflow :
– Les logiciels de Workflow qui permettent aux chercheurs de manipuler leurs données et exécuter leurs analyses sans posséder de connaissances en écriture de scripts ou en bases de données. Les données sont rapatriées au sein du logiciel de Workflow, permettant l’exécution d’un ensemble de tâches, à travers des modules pré-installés. En séquençage, le Workflow permet de convertir des séquences en formats divers, les filtrer ou les assembler… Le logiciel de Workflow ISYS (2001), BioMOBY, Taverna et plus particulièrement Galaxy (qui fera l’objet d’un prochain post ici) entrent dans cette catégorie.
– Les logiciels de Workflow qui assurent un accès direct à des composants (installés sur le serveur) et/ou aux données génomiques sans passer par un rapatriement préalable des données. WildFire, Pegasys ou Ergatis (ce dernier sera décrit dans un prochain post) font partie de cette catégorie. De manière générale ces logiciels de Workflow sont plus difficiles à prendre en main mais sont évidemment plus flexibles.
Pour résumer, quel que soit le logiciel de Workflow utilisé il permet :
– D’automatiser des processus d’analyse (idéalement répétitifs) en les reliant dans un pipeline
– De lancer des analyses sur des architectures matérielles complexes telles des grilles de calculs (voir l’article sur Grisbi) ou des serveurs
– De formaliser le processus d’analyse en vue d’une publication scientifique
Philosophie générale : interaction et exemple de workflow
Pour finir cette introduction, nous vous proposons deux schémas : la place du logiciel Workflow et un exemple concret.
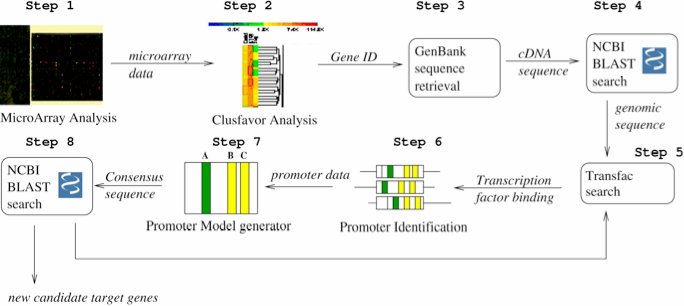
- Figure 1.3 : Exemple de conception d’un Workflow d’identification de promoteurs (extrait de « Accelerating the scientific exploration process with scientific workflows« )
Le PPF Bioinformatique de l’Université Lille 1, l’IFR 142 Médecine Cellulaire et Moléculaire de l’Institut Pasteur de Lille et l’IFR 114 Médecine Prédictive et Recherche Thérapeutique organisent une journée scientifique sur le thème de l’analyse bio-informatique des données produites par les technologies de séquençage à haut débit, dans la lignée de l’édition de 2009. Cette année, les sujets abordés couvriront plus particulièrement les données de type RNA-seq, ChIP-seq,…
Les exposés se tiendront dans l’amphithéatre Butiaux, sur le campus de l’Institut Pasteur de Lille (métro ligne 2, station Grand Palais).
Cette journée sera jumelée au workshop Algorithmique, combinatoire du texte et applications en bio-informatique, qui aura lieu à partir du lendemain au même endroit.
 pour but, à travers la mutualisation de ressources informatiques des acteurs du projet, de proposer l’utilisation d’applications bioinformatiques déployées sur grille de calcul au plus grand nombre.
pour but, à travers la mutualisation de ressources informatiques des acteurs du projet, de proposer l’utilisation d’applications bioinformatiques déployées sur grille de calcul au plus grand nombre.
Une revue intéressante et qui se veut exhaustive sur les conséquences de la généralisation des technologies de séquençage et les solutions/adaptations possibles, on y retrouve pèle-mêle :
– Un listing à jour (2011) des différentes plateformes dédiées à la génération de données de séquençage (Illumina, Roche, Life Technologie pour ne citer qu’eux…) et leurs spécificités;
– La description de quelques stratégies de NGS : identification de variants, séquençage d’éxome, séquençage sur des régions précises…
– Les problématiques en bioinformatiques : stockage et analyse de données, développement de solutions logicielles adaptées…
– Les différentes analyses ainsi que des listes de logiciels pour répondre aux besoins: assemblage denovo et sur génome de référence, annotation et prédiction fonctionnelle, autant open-source que sous licence payante.
Le ppf (Portail du Plan Pluriformation) bioinformatique de Lille 1 organise le 20 septembre prochain sur le campus de Lille 1 une journée scientifique sur la fouille de texte pour la biologie (extraction d’information en génomique, inférence des interactions géniques, …).
Le programme et les détails pratiques sont disponibles sur la page http://www.lifl.fr/~touzet/PPF/fouilletexte11.html
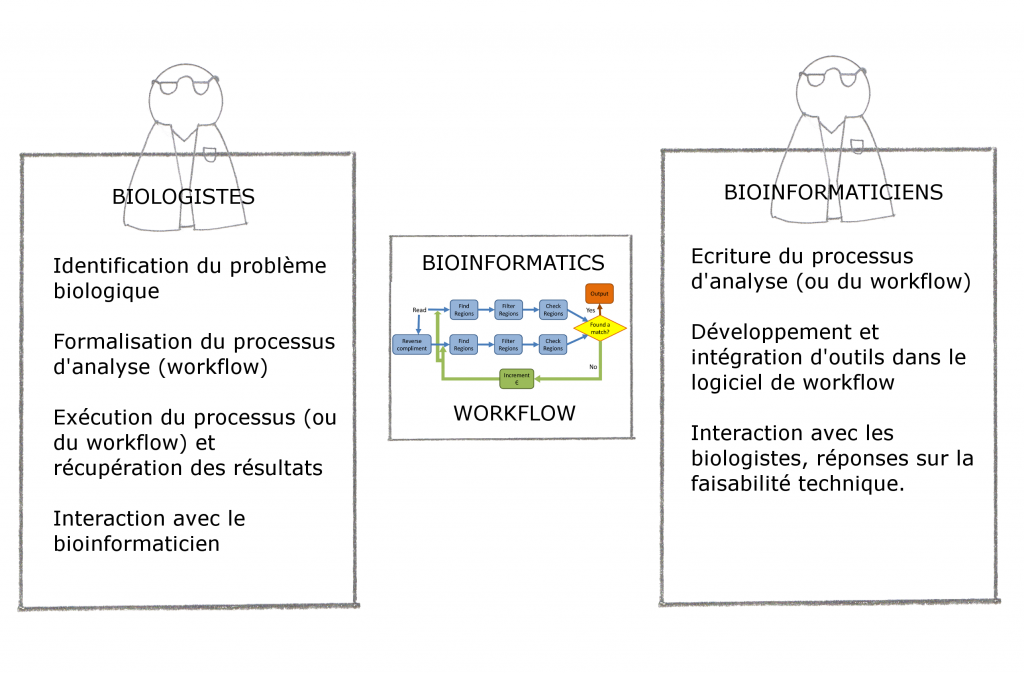
Il convient tout d’abord de distinguer deux types de bioinformaticiens :
-Ceux qui sont intégrés dans une unité de recherche : ils sont souvent spécialisés sur une thématique ou même un projet précis : généralement isolés, non permanent, impliqués et informés des problématiques biologiques
-Ceux qui font partie d’une unité de bioinformatique : en émulation avec d’autres bioinformaticiens, moins précaires, plus loin des problématiques biologiques
Ce document se veut une libre opinion sur la bonne intégration d’un, ou d’une équipe, de bioinformaticiens au sein d’un groupe de recherche et les clés pour la bonne réussite de celle-ci. Il est en grande partie inspiré de l’éditorial « On the organization of bioinformatics core services in biology-based research institutes » agrémenté de commentaires plus personnels.
Pour le bien-être interne et externe d’une plateforme de bioinformatique, il convient de :
-Bien séparer les tâches dîtes de prestation et les activités de recherches.
-Scinder les sujets traités par tâches bien définies : par exemple, support en développement et maintenance de base de données, analyse statistique de données haut-débit, support pour le déploiement d’applications sur environnement HPC, analyse de donnée NGS…
-Mettre en place un comité d’utilisateurs incluant des utilisateurs biologistes/bioanalystes chargés d’établir les priorités
-Mettre en place des outils pour suivre l’activité bionformatique de la façon la plus transparente possible
-Mettre en place au maximum des projets transversaux pour favoriser l’interface entre biologiste et bioinformaticiens, les interactions pluridisciplinaires sont les plus enrichissantes et souvent les plus productives. Comme toutes disciplines, la bioinformatique peut devenir endogame, particulièrement dans ou le cadre où l’on parle de bioinformatique comme une science à part entière, et non comme un outil au service de problématiques biologiques : une équipe de bioinformatique peut très bien travailler sur des sujets « porteurs » (donc plus facile à financer) sans interagir, ou seulement sporadiquement, avec des biologistes pour valider le bien-fondé du travail. C’est une des dérives du système d’évaluation actuel, pour plus d’information, lire la libre opinion publiée dans ce blog : Chemins de traverses : la recherche d’excellence ou quand les mots perdent leur sens.
-Mettre en place des formations pour les biologistes : collaborer avec des personnes connaissant un minimum les problématiques bioinformatiques est plus efficace
-Dans le même esprit, nommer un bioinformaticien responsable pour le support utilisateurs pour assister les biologistes dans leurs tâches quotidiennes de bioanalyse est très utile pour entretenir de bonne relation avec les laboratoires de recherche
-Pour les bioinformaticiens intégrés dans une unité, il est primordial de trouver des structures permettant de rencontrer et de partager avec d’autres bioinformaticiens, à défaut, passer quelques heures par semaine à effectuer de la veille technologique peut être un palliatif.
Pour conclure, une équipe de bioinformaticiens doit communiquer un maximum avec leurs partenaires biologistes afin de favoriser une saine interaction, un bioinformaticien, seul, entourer de biologistes se doit de rester à la page, idéalement en partageant et en communiquant sur ces projets à d’autres bioinformaticiens.
L’accroissement des capacités technologiques en biologie moléculaire à pour conséquence la possibilité de séquencer/génotyper mais aussi stocker toujours plus de données constituant une manne d’informations sans limite pour qui sait en extraire du sens. C’est le travail du bioinformaticien de proposer à la fois un support technique et analytique au biologiste en même temps que la capacité en terme de ressources informatiques pour répondre aux besoins.
Ce premier post sur la place du bioinformaticien se focalise sur l’interaction avec le biologiste au sein d’un projet.
On peut dissocier un projet en trois phases :
– La préparation : identifier la question biologique, étudier la faisabilité et les coûts, mettre en place la méthodologie…
– La réalisation : génération des données biologiques et analyse bioinformatique
– La finalisation : interprétation des résultats, mise en production ou introduction d’une nouvelle question biologique
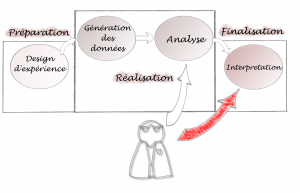
Le schéma ci-dessous montre un cheminement possible de l’intervention bioinformatique :
L’intervention du bioinformaticien est ici minimisée : il n’intervient qu’à partir de la phase analytique et dans l’interprétation des résultats (pour aider le biologiste à critiquer les résultats générés). Ceci pose plusieurs problèmes : les outils bioinformatiques doivent s’adapter, à tout prix, à la méthodologie mise en place précédemment. Si on constate que les méthodes d’analyses doivent être modifiées une fois la génération de données effectuées, la bioinformatique peut devenir ce qu’on appelle communément un goulot d’étranglement dans le projet…
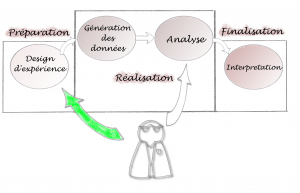
Au contraire, Le schéma ci-dessous nous parait plus judicieux :
Ici, l’intervention bioinformatique est optimisée : le bioinformaticien est totalement impliqué dans la préparation du projet. Et, au contraire, en fin de projet, les interventions sont minimisées car la méthodologie mise en place est adaptée pour une bonne compréhension par le biologiste. L’idéal et de fournir les outils nécessaires pour que le biologistes puisse lui-même exécuter ses analyses.
Pour résumer, l’ interaction doit se faire en amont et en aval de l’analyse et l’on se doit de minimiser les interventions pendant la phase d’analyse. En aval pour conseiller sur les méthodologies à utiliser, en amont pour contrôler les erreurs éventuelles rencontrées pendant la phase d’analyse (exécuter par le biologiste).
Qui sommes nous?
Christophe Audebert [@]
 En charge de la plateforme génomique
du département recherche et développement
de la société Gènes Diffusion .
En charge de la plateforme génomique
du département recherche et développement
de la société Gènes Diffusion .
Renaud Blervaque [@]
 Biologiste moléculaire, chargé d'études génomiques.
Biologiste moléculaire, chargé d'études génomiques.
Gaël Even [@]
 Responsable bioinformatique au sein
du département recherche et développement de la société Gènes Diffusion.
Responsable bioinformatique au sein
du département recherche et développement de la société Gènes Diffusion.
Catégories
- Analyse de données (14)
- Automatisation (5)
- Bioinformatique (27)
- Biologie (56)
- biologie transverse (35)
- Biotechnologie (30)
- Chronique littéraire (8)
- Comparatif (6)
- Diagnostic (8)
- Economie (17)
- Epidemiologie (2)
- Evénement (17)
- Formation (3)
- Gestion de projet (5)
- Grille de calcul (1)
- Intégration (5)
- Logiciels (8)
- Médecine (14)
- politique de la recherche (17)
- Recherche (21)
- Séquençage (70)
- Séquenceur (39)
- Uncategorized (25)
- Workflow (4)
Accès rapide aux articles
- Covid-19 : zoom sur les vaccins
- Comment l’ADN pourrait être le stockage de données du futur
- COVID-19 : la data visualisation au service de la science
- COVID-19 : des explications et un point d’étape au 20 février 2020
- Pour mettre du vin dans son eau
- Des petits trous, toujours des petits trous…
- Qui serait candidat ?
- Un robot pour analyser vos données…
- Monde de dingue(s)
- L’art et la manière de développer une qPCR
- Un MOOC Coursera sur le WGS bactérien
- Chercheurs & enseignants-chercheurs, l’art du multitâche.
- Un jeu de données métagénomiques
- Facteur d’impact
- Microbiote & smart city : juxtaposition de tendances
Accès mensuels
- février 2021 (1)
- décembre 2020 (1)
- février 2020 (2)
- septembre 2019 (1)
- avril 2018 (2)
- décembre 2017 (1)
- novembre 2017 (2)
- juillet 2017 (2)
- juin 2017 (5)
- mai 2017 (4)
- avril 2017 (3)
- mars 2017 (1)
- janvier 2017 (2)
- décembre 2016 (3)
- novembre 2016 (4)
- octobre 2016 (2)
- septembre 2016 (2)
- août 2016 (3)
- juillet 2016 (2)
- juin 2016 (4)
- mai 2016 (3)
- mars 2016 (1)
- novembre 2015 (2)
- avril 2015 (1)
- novembre 2014 (1)
- septembre 2014 (1)
- juillet 2014 (1)
- juin 2014 (1)
- mai 2014 (1)
- avril 2014 (1)
- mars 2014 (1)
- février 2014 (3)
- janvier 2014 (1)
- décembre 2013 (5)
- novembre 2013 (2)
- octobre 2013 (2)
- septembre 2013 (1)
- juillet 2013 (2)
- juin 2013 (2)
- mai 2013 (4)
- avril 2013 (2)
- mars 2013 (1)
- février 2013 (3)
- janvier 2013 (2)
- décembre 2012 (2)
- novembre 2012 (2)
- octobre 2012 (2)
- septembre 2012 (2)
- août 2012 (1)
- juillet 2012 (3)
- juin 2012 (5)
- mai 2012 (5)
- avril 2012 (6)
- mars 2012 (6)
- février 2012 (8)
- janvier 2012 (6)
- décembre 2011 (5)
- novembre 2011 (6)
- octobre 2011 (6)
- septembre 2011 (7)
- août 2011 (5)
- juillet 2011 (8)
Pages